شیوههای نوین تشخیص آزمایشگاهی و درمان برای انواع سرطان سینه
سرطان سینه شایعترین بدخیمی و اولین عامل مرگ و میر در بین خانمهاست. تشخیص به موقع سرطان سینه درمان آن را آسانتر و موفقیت آمیزتر خواهد کرد. بنابراین میتوان باانجام تست HER2 که به بررسی ژن شاخص ERBB2 که بطور معمول HER2 خوانده میشود در تعیین وضعیت پیشرفت بیماری و پیش آگهی در افراد مبتلا نقش به سزایی داشت.آزمایش HER2 در آزمایشگاه پیوند با تکنیک FISH بر روی بلوک پارافینه انجام میشود.
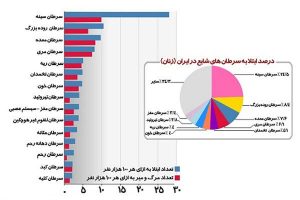
سرطان یکی از اصلیترین عوامل مرگ و میر در جهان است و سرطان سینه شایع ترین بدخیمی و اولین عامل مرگ و میر در بین خانم هاست. این بیماری سهم حدود 25 درصدی از کل بدخیمیها را به خود اختصاص داده و باعث 3/3 مرگ از هر صد هزار نفر میگردد. در تهران شیوع این بیماری حدود 5/25 درصد از کل سرطان هاست (1).
عوامل خطر ساز سرطان سینه
در مطالعات مربوط به سرطان سینه تا کنون علت دقیقی برای ایجاد این سرطان ذکر نشده است. اما فاکتورهای خطرناک (ریسک فاکتورها) متعددی در ایجاد این بیماری نقش دارند؛ که از جمله آنها میتوان به: سن، جنس، عوامل ژنتیکی، سابقه فردی و یا خانوادگی ابتلا به بیماری، نژاد، هورمونها، چاقی و کم تحرکی، رژیم غذایی، مصرف الکل و وجود سلولهای هیپرپلاستیک آتیپیک در اثر بیوپسی های نامتعارف از سینه اشاره نمود(2).
نقش پروتوانکوژن HER2
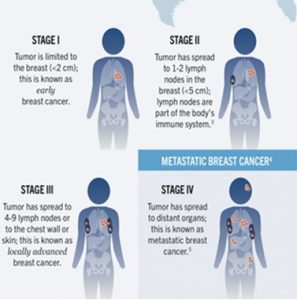
بررسی ژن شاخص ERBB2 که بطور معمول HER2[1] خوانده میشود در تعیین وضعیت پیشرفت بیماری و پیش آگهی در افراد مبتلا مهم بوده است (3). تشخیص به موقع از مراحل اولیه سرطان سینه نقش بسزایی در مدیریت بیماری برای ایجاد عوارض کمتر بر سایر ارگان های بدن در اثر رشد تومور خواهد داشت که بر بهبود کیفیت زندگی و طول عمر بیماران موثر است (شکل 3).
[1] HER2: human epidermal growth factor receptor 2
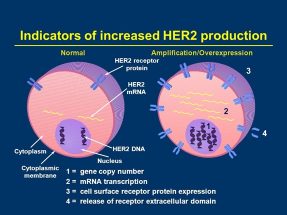
ژن HER2 که بعنوان انکوژنی بر روی بازوی بلند کروموزوم 17 قرار دارد از مراحل اولیه سرطان سینه شروع به تکثیر می کند که در کارسینوماهای درجا (Insitu) در مجاری غدد شیری حدود 50% و در تومورهای سینه تقریباً 20% ژن HER2 تکثیر مییابد. متعاقب تکثیر 50-25 نسخه از ژن HER2 افزایش 100-40 برابری تولید پروتئین HER2 در سلولهای تومورال سینه در مطالعات اخیر گزارششده است(3). دراوایل سال 1980 نقش گیرنده Erb2 در تومورزایی در سرطان پستان مشخص شد. ژن گیرنده فاکتور رشد اپیدرمی انسانی که با نام C-Erb2/Neu یا HER2/Neu نیز خوانده می شود یک گیرنده گلیکوپروتئینی غشایی با 1522 آمینواسید و وزن 185 KD را از خانواده تیروزین کینازها کد میکند. HER2 دومین عضو خانواده HER از کلاس I گیرنده های تیروزین کینازی فاکتورهای رشد میباشد. خانواده HER شامل HER1، HER2، HER3 و HER4 است. این گیرنده به صورت همودایمر یا هترودایمر با سایر اعضا خانواده گیرنده فاکتور رشد اپیدرمی باعث انتقال پیام می شود. هترو دایمر شدن آن بستگی به لیگاند سایر اعضاء خانوادهEGFR ها دارد(4). تکثیر و بیان بیش از حد HER2 در سلولهای سرطان پستان با افزایش اندازه تومور، افزایش طول فاز S چرخه سلولی، آنیوپلوئیدی و کاهش بیان گیرنده های هورمون های استروژن و پروژسترون همراه است و در 30-25% مبتلایان به این سرطان افزایش بیان گیرنده HER2 دیده می شود(5).
هرسپتین
با تشخیص به موقع و دقیق از وضعیت تکثیر این ژن میتوان با استفاده از داروهای مناسبی چون [pertuzumab, lapatinib, trastuzumab [Herceptin, از تکثیر پروتئین تولیدشده توسط این ژن تا حد زیادی جلوگیری نمود(6). در افرادی که برای اولین بار هرسپتین را دریافت میکنند عوارض جانبی چون تب و لرز مشاهده شده است و بعضاً برخی از زنان علائمی چون درد، ضعف، تهوع، استفراغ، اسهال، سردرد، سختی در تنفس، یا بثورات جلدی هم خواهند داشت. در صورتیکه تشخیص صحیحی از ارزیابی این بیماری در استفاده از هرسپتین انجام نپذیرد عوارض زیان باری را بههمراه خواهد داشت که مهمترین آنها اختلال 30-5% پمپاژ خون از عملکرد قلب میباشد؛ بطوریکه در
4-1% موارد با عوارض شدید قلبی چون احتقانی قلب (congestive cardiac failure) که با علائم تنگی نفس، خستگی مفرط و ورم ساق پا همراه است(7).
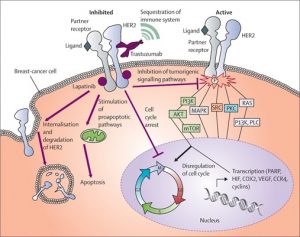
مکانیسم سلولی Herceptin
هرسپتین یا Trastuzumab از آنتی بادیهای مونوکلونال انسانی است که بر علیه محصول پروتوانکوژن HER2 عمل می کند. در واقع ناحیه45D از CDR آنتی بادی مونوکلونال انسانی، هرسپتین را بوجود آورده که بر علیه دومن خارج سلولی HER2 وارد عمل می شود (8). شکل6 به تشریح مکانیسم عملکرد هرسپتین علیه گیرنده HER2 میپردازد. اتصال هرسپتین به دومین خارجی رسپتور تیروزین کیناز (PTK) منجر به داخلی شدن (Internalization) رسپتور و باعث مهار مسیر پیام رسانی PI3K میگردد. در این مکانیسم با اتصال هرسپتین به HER2 کاهش فسفریلاسیون PTEN در اسید آمینه تیروزین اتفاق می افتد و PTEN بیشتر در غشا قرار میگیرد. PTEN با فعالیت فسفاتازی باعث دفسفریلاسیون AKT شده و در نهایت مهار رشد و تقسیم سلولی را به دنبال دارد (9). در این صورت مهار سیکل سلولی و نیز مسمومیت سلولی وابسته به آنتی بادی (ADCC) را بعلت پاسخهای ایمنی و فعال شدن سلول های NK و در نهایت لیز سلولی میتوان مشاهده کرد(10).
هرسپتین همچنین قادر است از برش و تجزیه HER2 جلوگیری نموده و مانع تشکیل یک رسپتور ناقص متصل به غشاء (P95) و در عین حال فعال همیشگی گردد. P95 فعالیت کینازی دارد و در تکثیر سلول نقش اساسی دارد (11). هرسپتین با مهار متالوپروتئازها مانع از برش و تجزیه HER2 میگردد. علاوه بر مهار فعالیت HER2 و نتیجتاً مهار تکثیر توموری، هرسپتین منجر به ایستایی و مرگ سلولی میشود(9). در واقع هرسپتین با مهار Cyclin D1 و در نتیجه مهار Inhibitor cdk inhibitor P27 باعث آزاد شدن پروتئین P27 شده که نقش مهارکنندگی کمپلکس Cyclin E/CDK2 را دارد بنابراین سلول در G1 متوقف میگردد هرسپتین همچنین با کاهش بیان VEGF باعث مهار رگ زایی و پیشرفت تومور می شود(11). در بررسی میزان تکثیر ژن HER2 در نمونه های تثبیت شده در بلوک پارافینه پیش از تکنیک FISH از روش های بلاتینگ چون ساترن بلاتینگ، وسترن بلاتینگ، نورتون بلاتینگ و ایمونوهسیتوشیمی استفاده شده است.
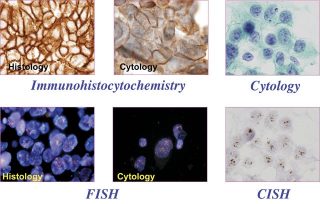
تفسیر و ارزیابی عملکرد سه روش دو رگه سازی (هیبریدیزاسیون) IHC ، CISH ، FISH در تشخیص هیستوپاتولوژی
ایمونوهیستوشیمی –IHC(Immunohistochemistry):
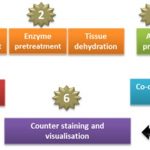
ترکیبی از تکنیکهای ایمونولوژی، بافتشناسی و بیوشیمیایی است که برای تشخیص اختصاصی اجزای (آنتیژنهای پروتئینی) بافتها، بواسطه آنتیبادیهای کنژوگه شده از طریق یک واکنش آنتیژن- آنتیبادی، استفاده میشود (۱2). تا سال ۱۹۴۱ تشخیص آنتیژنها در سطوح بافتی امکانپذیر نبود، و در این سال Dr.Albert,Coons ابتدا این تکنیک ایمونوفلورسانس را مطرح، و سپس آنرا اجرایی کرد. در دهههای اخیر توانایی تشخیص آنتیژنها در برشهای بافتی به سرعت بهبود و افزایش یافته است (۱2,13). ایمونوهیستوشیمی (IHC) یک تکنیک رنگآمیزی است که برای اندازهگیری کمی و کیفی میزان بیان آنتیژنهای پروتئینی در نمونههای بیولوژیک و بافتی، بواسطه اتصال آنتیبادی اختصاصی به آنتیژن هدف، کاربرد دارد (14).از روش رنگ آمیزی ایمونوهیستوشیمی امروزه بطور گسترده در بخشهای هیستوپاتولوژی دنیا استفاده می شود . ارزیابی ژنهای اختصاصی بافتها از طریق ایمونوهیستوشیمی، به طور قابل ملاحظهای در طبقهبندی تومورها در هر یک از مراحل تشخیصی نقش دارد (15) .
متداولترین روشهای رنگ آمیزی ایمونوآنزیماتیک که با میکروسکوپ نوری مطالعه میشود عبارتند از روشهای مستقیم ،غیرمستقیم دو مرحله ای ،غیرمستقیم سه مرحله ای ،پراکسیداز،آنتی پراکسیداز و آویدین – بیوتین . کمپلکس پراکسیداز- آنتی پراکسیداز عبارت است از سه مولکول پراکسیداز و دو پادتن بر علیه آنزیم پراکسیداز که نتیجه عالی بر روی نمونه های بافتی معمولی fixed و paraffin embedded می دهد و میتوان بوسیله آن آنتی ژنهای موجود در بافتها و یا سلولها را نشان داد.
اصل ایمونوهیستوشیمی، ردیابی آنتیژنها در برشهای بافتی با استفاده از آنتیبادیهای کنژوگه شده با مواد فلوروسنت، آنزیمها و عناصر رادیواکتیو میباشد. بعد از اتصال آنتیبادی کنژوگه شده به آنتیژن هدف در سطح بافت و تولید یک محصول رنگی طی واکنش هیستوشیمی[رنگزا] (16)، با میکروسکوپ نوری یا میکروسکوپ فلوروکروم و با نور ماوراء بنفش [UV] (17) میتوان محصول رنگی را که در واقع محل بیان آنتیژن موردنظر است، تشخیص داد (12,16).
دورگه سازي در محل با مواد رنگی غیررادیواکتیو-(CISH) Chromogenic in situ hybridization
نوع دیگري از دورگه سازي در محل (ISH) است که بسیار شبیه FISH میباشد با این تفاوت که در این تکنیک پروب بعد از دورگه سازي، با استفاده از یک واکنش رنگ زا مشاهده می گردد. روش CISH مزایای فراوانی را نسبت به FISH دارد. یکی از مزایای اصلی این تکنیک امکان مشاهده اسلاید ها توسط میکروسکوپ نوری و تشخیص ساختار بافت است. علاوه بر این CISH می تواند همراه با ایمونوهیستوشیمی براي سنجش ارتباط بین تغییرات کروموزومی و بیان ژن، مورد استفاده قرار گیرد. اسلایدهاي تهیه شده در این تکنیک، پایداري بالایی دارند و پس از تجزیه و تحلیل، براي نگهداري و بایگانی طولانی مدت مناسب هستند.
یکی از معایب CISH توانایی تشخیص فقط یک سیگنال در یک زمان است و سیگنال هاي تولید شده با CISH نسبت به سیگنال هاي تولید شده باFISH گسستگی کمتري دارند و باعث کاهش دقت در تعیین شمارش سیگنال می گردد. براي مثال در نوعی آزمون تجاري FISH از دو پروب (یک پروب سبز براي سانترومر کروموزوم 17 و یک پروب قرمز براي ژن ERBB2) استفاده شده است . با چنین آزمونی اگر نسبت سیگنال HER2/Cep17 بیش از 2 باشد نشان دهنده تکثیر ژن HER2 بوده و مستعد درمان با هرسپتین است. علت اساسی استفاده از پروب Cep17 در این مجموعه پروب ها، پلی زومی کروموزوم 17 در برخی از تومورها است . در مواردي که بیش از دو رونوشت از ژن HER2 وجود داشته باشد و زیاد بودن تعداد رونوشت هاي ژن HER2 ناشی از تقویت آن نباشد دانستن نسبت ها، با استفاده از آزمون CISH امکان پذیر نیست(18).
دورگه سازي در محل با مواد فلورسنس : ظهور دورگه سازي در محل با مواد فلورسنس (Fluorescence InSitu Hybridization)
تکنیک FISH در دهه 1980 انقلاب دیگري را در تجزیه و تحلیل سیتوژنتیکی ایجاد نمود روش FISH به عنوان تکنیکی جهت شناسایی تریزومی ها و جا به جایی ها در هسته هاي متافازي و اینترفازي با استفاده از کتابخانه هاي DNA معرفی گردید . این تکنیک ابزار بسیار مناسبی براي مطالعه ساختار و عملکرد کروموزوم ها، پلی پلوییدي، انیوپلوییدي، دخول ژن بیگانه، تکامل ژنوم و تعیین نقشه فیزیکی ژن ها می باشد. در FISH از DNA پروب هاي نشاندار با مواد فلورسنت جهت تعیین جایگاه هاي کروموزومی درون هسته استفاده می شود.
مواد فلورسنت سیگنال هاي رنگی ایجاد می کنند و با استفاده از میکروسکوپ فلورسنت مورد شناسایی قرار می گیرند. برخلاف تجزیه و تحلیل کاریوتایپ متافازي حاصل از روش هاي سیتوژنتیکی معمول، در تکنیک FISH نیازي به کشت سلول نیست و براي انجام آن می توان به طور مستقیم از سلول ها و بافت هاي تازه یا بافت تثبیت شده با پارافین جهت ارزیابی سریع استفاده نمود. در سال هاي اخیر، همراه با کشف تعداد بی شماري از ژن هاي مرتبط با بیماريها، کاربردهاي FISH در تشخیص بیماري هاي ژنتیکی، بدخیمی هاي خونی و تومورها گسترش یافته است. براي مثال تشخیص جا به جایی BCR/ABL1 تکثیر بیش از حد ژن HER2 و نوآرایی ALK با استفاده از FISH جهت درمان هدفمند لوسمی میلوییدي مزمن، سرطان پستان و آدنوکارسینوماي ریه از اهمیت زیادي برخوردار است.
بنابراین آزمون هايFISH به عنوان مولفههاي اساسی پزشکی منحصر به شخص(Personalized Medicine) مورد تایید قرار گرفتهاند. از جمله کاربرد های تشخیصی FISH می توان به: شناسایی ناهنجاريهاي کروموزومی خاص، شناسایی کروموزوم هاي مارکر، بررسی پیشرفت بیماري، بررسی موفقیت پیوند مغز استخوان، کاربردهاي پژوهشی : تعیین نقشه ژنتیکی، شناسایی مناطق حذف یا مضاعف شده، شناسایی نقاط شکست در جا به جایی ها، مطالعه سه بعدي سازمان یافتگیِ کروموزوم ها اشاره داشت(18). در این راستا تکنیک FISH توانسته بعنوان راهکاری مناسب برای تائید میزان تکثیر ژن HER2 در نمونه های با گزارشIHC +2 or +3 و کمک به توانایی تشخیصی در امر درمان برای جامعه پزشکان باشد(19و20).
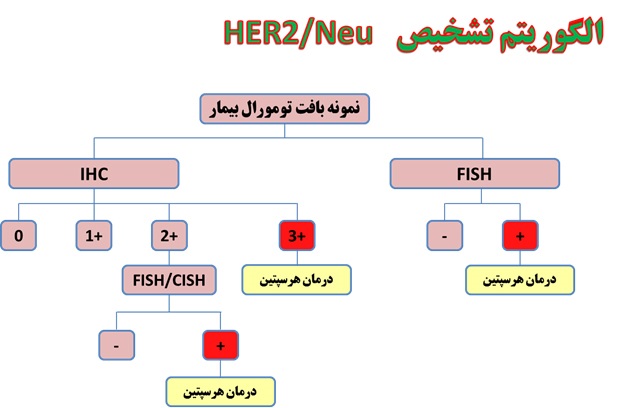
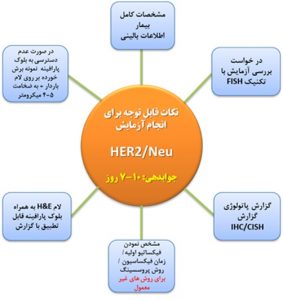
الگوریتم تشخیص HER2/Neu
فرآیند انجام آزمایش HER2 با تکنیک FISH بر روی بلوک پارافینه درآزمایشگاه پیوند
از نمونه های تثبیت شده در بلوک پارافینه برش های به ضخامت 5-4 میکرومتر بر روی لام با شارژ مثبت تهیه می شود و پس از انجام تیمار های لازم لام مربوط برای هیبریداسیون با پروب HER2 آماده می شود(21). اما قبل از آن بایستی ناحیه و یا نواحی هدف توسط پاتولوژیست تعیین و عیناً همان مناطق جهت بررسی بر روی لام مورد مطالعه نشانه گذاری شود(21).
A normal result occurs when:
- the HER2/17 centromere signal ratio <2.0
- the average Her2 copy number <4.0 signals per cell
- that these observations are within a homogenously contiguous population
- and with >10% of invasive tumors cells present.
An equivocal result occurs when:
- the HER2/17 centromere signal ratio <2.0
- the average Her2 copy number is >4.0 and <6.0 signals per cell
- that these observations are within a homogenously contiguous population
- and with >10% of invasive tumors cells present.
An amplified result occurs when:
- the HER2/17 centromere signal ratio >2.0 with an average Her2 copy number that less
- than, equal to or greater than 4.0 signals per cell
- or with the HER2/17 centromere signal ratio <2.0 if the average Her2 copy number >6.0
- signals per cell
- that these observations are within a homogenously contiguous population
- and with >10% of invasive tumors cells present.
:منابع
- dolat E, hasanzadeh H, rezaee tavirani M, heidari kashl S, jabari arfeei A, seiedi S, et al . Evaluation of Synergistic Effect of TiO2 Nanoparticles and Gamma Rays on Human Breast Cancer Cell Line. sjimu. 2013; 20 (4) :223-230
- Higginson I, Costantini M. Dying with cancer, living well with advanced cancer. European J of Cancer 2008;44: 1414-1424.
- Zneimer S. Cytogenetic Abnormalities: Chromosomal, FISH, and Microarray-Based Clinical Reporting and Interpretation of Result. John Wiley & Sons; 2014 Aug 21.
- Bartlett JMS, Going JJ, Mallon EA et al. Evaluating HER2 amplifcation and expression in breast cancer. J Pathol 2001 195:422–428.
- Yarden Y. Biology of HER2 and its importance in breast cancer. Oncology.2001 61(suppl2):1 13.
- Romond EH, Perez EA, Bryant J, et al: Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005 Oct 20;353(16):1673-1684
- Web site: http://www.breastcancer.org/treatment/targeted_therapies/herceptin
- Arnould L, Gelly M, Penault-Llorca F, et al. Trastuzumab-based treatment of HER2+ breast cancer: an antibody-dependent cellular cytotoxicity mechanism? Br J Cancer 2006.94(2):259-267.
- Yakes FM, Chinratanalab W, Ritter CA, et al. Herceptin-induced inhibition of phosphatidylinositol-3 kinase and Akt Is required for antibody-mediated effects on p27, cyclin D1, and antitumor action. Cancer Res. 2002 62(14):4132-4141.
- Cooley S, Burns LJ, Repka T et al. Natural killer cell cytotoxicity of breast cancer targets is enhanced by two distinct mechanisms of antibody-dependent cellular cytotoxicity against LFA-3 and HER2/Neu. Exp Hematol 1999 27: 1533–1541.
- Valabrega G, Montemurro F, Aglietta M. Trastuzumab: mechanism of action, resistance and future perspectives in HER2-overexpressing breast cancer. Ann Oncol 2007 18: 977-984.
- Ramos-Vara J. Technical aspects of immunohistochemistry. Veterinary Pathology Online. 2005;42(4):405-26.
- Ramos-Vara J, Miller M. When Tissue Antigens and Antibodies Get Along Revisiting the Technical Aspects of Immunohistochemistry—The Red, Brown, and Blue Technique. Veterinary Pathology Online. 2014;51(1):42-87.
- Miller RT, Kubier P. Immunohistochemistry on cytologic specimens and previously stained slides (when no paraffin block is available). Journal of Histotechnology. 2002;25(4):251-7.
- Furuya T, Ikemoto K, Kawauchi S, Oga A, Tsunoda Si, Hirano T, et al. A novel technology allowing immunohistochemical staining of a tissue section with 50 different antibodies in a single experiment. Journal of Histochemistry & Cytochemistry. 2004;52(2):205-10.
- Ward J, Rehg J. Rodent Immunohistochemistry Pitfalls and Troubleshooting. Veterinary Pathology Online. 2013:0300985813503571
- Bendayan M. Possibilities of false immunocytochemical results generated by the use of monoclonal antibodies: the example of the anti-proinsulin antibody. Journal of Histochemistry & Cytochemistry. 1995;43(9):881-6
- نزهت زهرا و هدايتي مهدي. “دورگه سازي در محل، اصول و کاربردها: مقاله مروري- مجله دانشکده پزشکی، دانشگاه علوم پزشکی تهران، خرداد 1394 ، دوره 73 ، شماره3، صفحه هاي 143-157.
- Wolff AC, Hammond ME, Hicks DG, et al: Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society for Clinical Oncology/College of American Pathologists clinical practice guideline update. J Clin Onc 2013 Nov 1;31(31):3997-4013
- Perez EA, Roche PC, Jenkins RB, et al: HER2 testing in patients with breast cancer: poor correlation between weak positively by immunohistochemistry and gene amplification by fluorescence in situ hybridization. Mayo Clin Proc 2002 Feb;77(2):148-154
- Duffy, Lisa, et al. “Quality control considerations for fluorescence in situ hybridisation of paraffin-embedded pathology specimens in a diagnostic laboratory environment.” Latest Research into Quality Control. InTech, 2012